
1
有关水方面的
1.相对分子质量最小的氧化物是水;
2.在101千帕、4 ℃时水的密度最大值为1g/cm3
3.地球表面上分布最广的非气态物质是水;
4.动植物体内含量最多的是水;
5.最常用的溶剂是水;
2
有关燃料方面的
6.当今世界上最重要的三大化石燃料是煤、石油、天然气;
7.最简单的有机物是甲烷;
8.最理想的气体燃料是氢气;
3
有关元素方面的
9.地壳中含量最多的元素是氧元素;
10.地壳中含量最多的非金属元素也是氧元素;
11.地壳中含量最多的金属元素是铝;
12.空气中体积分数最大、质量分数最大的物质是氮气、最多的元素也是氮元素;
13.相对原子质量最小的是氢原子;
14.元素中原子的质子最少的是氢原子;
15.含氮量最高的常见化肥是尿素;
16.形成化合物种类最多的元素是碳元素;
17.人体中含量最多的元素是氧元素;
18.宇宙中含量最多的元素是氢元素;
4
有关金属物质方面的
19.导电性最好的金属是银。
20.在金属活动顺序中:最活泼的金属是钾;最不活泼的金属是金;熔点最低的金属是水银--汞。
21.在金属活动顺序中:等质量的活泼金属与足量的盐酸反应产生氢气最多的是铝。
22.铁在潮湿空气中最易生锈,防止铁生锈最常用的方法是在铁制品的表面涂上一层保护膜。
5
有关化学史方面的
23.最早使用天然气的国家是中国。
24.我国古代“四大发明”中与化学知识联系最密切的两大发明是造纸.制火药。
25.世界上最早应用“湿法冶铜”的国家是中国。
26.最先提出近代原子说的科学家为英国的道尔顿。
27.最早通过实验得出空气是由氧气和氮气组成的结论是法国化学家拉瓦锡。
6
有关原子结构,电子排布方面的
28.在含多电子的原子中,能量最低的电子层是第一电子层,离核最近的电子层是第一层。
29.与元素化学性质关系最为密切的是原子的最外层电子数。
30.元素间最本质的区别是核电荷数即质子数。
7
有关实验操作方面的
31.使用量筒量液体体积时,量筒要放平稳,读数时应使视线与量筒内的凹液面最低处保持水平。
32.测定溶液PH最简便的方法是使用PH试纸
33.取用药品时,如果没有说明用用量,应使用最少量,液体1-2毫升,固体盖满试管底部。
34.实验室最常用的加热工具是酒精灯,其外焰燃烧最充分,温度最高;焰心燃烧不充分,温度最低。
35.试管液体加热时,液体的体积最好不超过试管容积的三分之一。
初中化学四大基本反应类型包括:化合反应、分解反应、置换反应、复分解反应
一、化合反应
1.概念
化合反应是由两种或两种以上物质生成另一种物质的反应。
2.特点(多变一)
A+B+...=C (化合价可变可不变)
(1)生成物是一种物质。
(2)反应物不止一种物质。
(3)生成物一定要有固定组成,是纯净物。
3.判断
判断一个反应是不是化合反应要着重于化合反应的概念及反应特点。若要判断一个反应化学方程式是否属化合反应,要以此反应能够发生为前提,然后与化合反应的所有特点相对照,只有同时具有三个反应特点,才能确定为化合反应。否则,不能列入化合反应。
二、分解反应
1.概念
分解反应是由一种物质生成两种或两种以上其他物质的反应。
2.特点(一变多)
A= B+C+...(化合价可变可不变)
(1)反应物是一种物质。
(2)生成物不止一种物质。
(3)反应物有固定组成,是纯净物。
3.判断
反应能发生的前提下,看此反应是否具有分解反应的三个特点。
三、置换反应
1.概念
置换反应是由一种单质跟一种化合物起反应,生成另一种单质和另一种化合物的反应。
2.特点
A+BC=AC+B 简记为“一换一”。
(1)反应物和生成物都是两种物质。
(2)反应物是一种单质和一种化合物,生成物是另一种单质和另一种化合物。
3.判断
注意:
(1)反应物一定是单质与化合物;
但有单质和化合物参加的反应不一定是置换反应。
如CH4+2O2 CO2+2H2O。
CO2+2H2O。
(2)生成物一定是单质与化合物。
但有单质和化合物生成的反应不一定是置换反应。
如CO+CuO Cu+CO2。
Cu+CO2。
4.典型反应置换反应根据反应发生的环境可分为在溶液中和干态下的置换反应。
(1)溶液中的置换反应:金属+酸=盐+H2↑,
如:Zn+2HCl=ZnCl2+H2↑
(2)溶液中的置换反应:金属+盐溶液=盐+金属,
如:Fe+CuSO4=FeSO4+Cu
(3)干态下的置换反应:
初中所学的有还原氧化铜的反应。CuO+H2△Cu+H2O
2CuO+C高温2Cu+CO2↑
置换反应的美丽动图~

Zn+Pb(NO3)2=Pb+Zn(NO3)2

Zn + 2AgNO3= Zn(NO3) 2+ 2Ag

Zn + CuSO4 = ZnSO4 + Cu

Zn + 2AgNO3= Zn(NO3) 2+ 2Ag
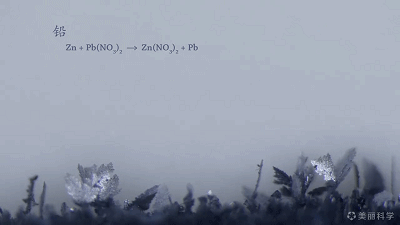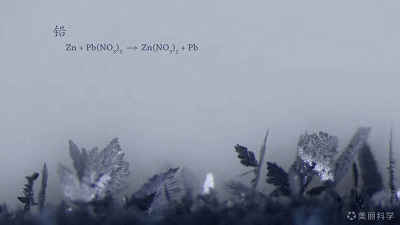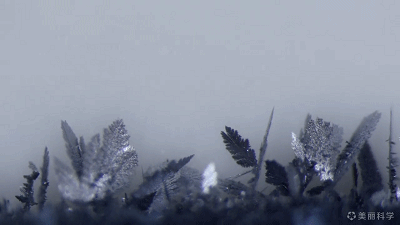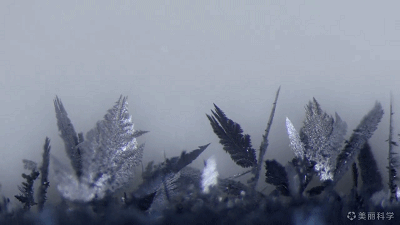
Zn+Pb(NO3)2=Pb+Zn(NO3)2
四、复分解反应
1.概念
复分解反应是由两种化合物互相交换成分,生成另外两种化合物的反应。
2.特点
AB+CD=AD+BC (化合价不变)
(1)生成物、反应物都是两种物质。
(2)所有的生成物和反应物都是化合物。
(3)反应在溶液中一步进行。
3.反应发生的条件
(1)反应物必须能溶于水或酸。
(2)生成物中必须有沉淀、气体和水三者中的任一种或两种物质生成。
4.判断
断定一个反应是不是发生了复分解反应,必须要符合复分解反应的特点及反应发生的条件,只有同时具备,才是发生了复分解反应。
注意:酸碱盐之间并不是都能发生复分解反应的。
5.典型反应
(1)酸+碱=盐+水(中和反应),如:2HCl+Ca(OH)2=CaCl2+2H2O
(2)酸+盐=新酸+新盐,如:HCl+AgNO3=HNO3+AgCl↓
(3)碱+盐=新碱+新盐,如:Ca(OH)2+Na2CO3 =2NaOH+CaCO3↓
(4)盐+盐=两种新盐,如:BaCl2+Na2SO4=2NaCl+BaSO4↓
(5)酸+金属氧化物=盐+水
如Fe2O3+6HCl=2FeCl3+3H2O, H2SO4+CuO=CuSO4+H2O
沉淀反应的美丽动图~

NaCl+AgNO3=AgCl↓+NaNO3
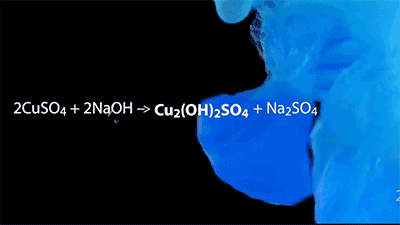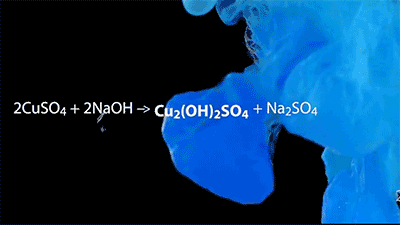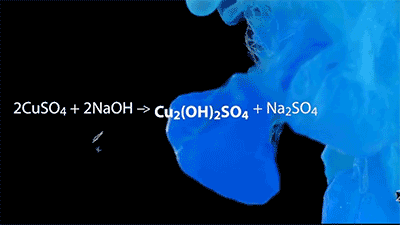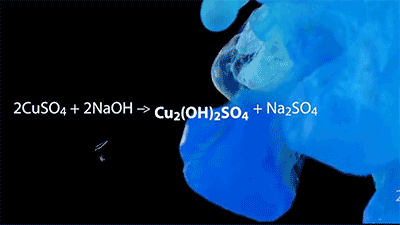
CuSO4+2NaOH→Cu(OH)2↓+Na2SO4
来源于网络,侵删!
